|
Сотрудники
Проф. Е.В. Даев
Доц. Л.В. Барабанова
Доц. Е.В. Голубкова – заведующая специализацией "Генетика животных"
Доц. С.А. Галкина
Ст. преп. П.А. Мелентьев
М.н.с. Т.С. Глинин
Основные направления исследований
Тематика работ нашей специализации затрагивает самые разные направления исследований.
- Стресс и мутагенез. Рук. Е.В. Даев. Генетическая нестабильность в клетках различных органов и тканей при стрессе у мышей и крыс.
- Генетика домашних животных. Рук. Л.В. Барабанова. Молекулярная генетика домашних животных, генетический анализ пород, генетика окрасов, генетика заболеваний.
- Цитогенетика и геномика птиц и рептилий. Рук. С.А. Галкина. Анализ распределения и функционирования повторяющихся элементов в геномах птиц и рептилий, цитогенетическая верификация и заполнение пробелов в существующих сборках геномов птиц, анализ хромосом типа ламповых щеток в ооцитах птиц, филогеномика.
- Молекулярно-генетические механизмы индивидуального развития на модели Drosophila melanogaster. Рук. Л.А. Мамон.
- Генетика человека. Работы выполняются при взаимодействии с лабораторией пренатальной диагностики института акушерства, гинекологии и репродуктологии им. Д. О. Отта.
Многие исследования осуществляются в тесном сотрудничестве и на базе лабораторий ЦИНа, ПИЯФа, ЗИНа, ИЭМа, Института физиологии им. И.П. Павлова.
Темы дипломных работ 2020-2021 (в скобках - руководители)
- Поиск мутаций в гене FGF4 и его ретрогенах у собак породы французский бульдог (Л.В. Барабанова)
- Генетические механизмы следствий развития стресс-реакции у грызунов (Е.В. Даев)
- Последствия дестабилизации генома при стрессе в клетках головного мозга и других органов у млекопитающих (Е.В. Даев)
- Изучение наследственных факторов в развитии нервно-мышечных заболеваний (П.А. Мелентьев)
- Поиск конвергентных адаптивных замен у горных грызунов (Н.И. Абрамсон)
- Анализ последовательностей сохраняемых интронов, влияющих на транспорт и трансляцию мРНК, в транскриптах гена Nxf1 (Е.В. Голубкова)
- Влияние экзогенного лактоферрина на эпигеномные изменения в культуре клеток человека IMR-32 (Е.В. Голубкова, научный консультант И.О. Сучкова, ФГБНУ «ИЭМ»)
- Влияние нокаута генов субъединиц иммунопротеасомы на плюрипотентность и дифференцировку эмбриональных стволовых клеток мышей (Е.В. Даев, научный консультант А.С. Цимоха, ЦИН)
- Изучение физико-химических, токсических и трансфекционных свойств электростатически стабилизированных нуклеопептидных комплексов (С.А. Галкина, научный консультант А.В. Киселёв, НИИ АГиР им. Д.О. Отта)
- Изучение электростатически стабилизированных нуклеопептидных комплексов для направленной доставки ДНК в мышечные клетки (С.А. Галкина, научный консультант А.В. Киселёв, НИИ АГиР им. Д.О. Отта)
- Исследование модульных носителей, модифицированных лигандом αvβ3-интегринов, для направленной доставки ДНК с целью суицидной генной терапии миомы матки (Т.С. Глинин, научный консультант А.В. Киселёв, НИИ АГиР им. Д.О. Отта)
- Изучение эффекта комбинированной доставки миРНК в опухолевые клетки с помощью пептидных носителей (Л.В. Барабанова, научный консультант А.В. Киселёв, НИИ АГиР им. Д.О. Отта)
- Разработка невирусных носителей для доставки миРНК в клетки рака молочной железы с целью генной терапии (Л.В. Барабанова, научный консультант А.В. Киселёв, НИИ АГиР им. Д.О. Отта)
- Влияние диетических и генетических факторов на метаболизм меди в печени и белой жировой ткани у лабораторных мышей (С.А. Галкина, научный консультант Е.Ю. Ильичева, ФГБНУ «ИЭМ»)
- Апробация “AmpliSeq панели” для неинвазивного пренатального скрининга моногенных заболеваний (А.С. Глотов, НИИ АГиР им. Д.О. Отта)
- Особенности профиля микроРНК в зависимости от рецептивности эндометрия (А.С. Глотов, НИИ АГиР им. Д.О. Отта)
Сотрудничество
- Институт Цитологии РАН, Санкт-Петербург
- Институт физиологии им. И.П. Павлова, Санкт-Петербург
- Петербургский институт ядерной физики им. Б. П. Константинова национального исследовательского центра «Курчатовский институт», Санкт-Петербург
- Зоологический институт РАН, Санкт-Петербург
- Институт экспериментальной медицины, Санкт-Петербург
- НИИ АГиР им. Д.О. Отта, Санкт-Петербург
- НМИЦ онкологии им. Н.Н. Петрова, Санкт-Петербург
- CAS-MPG Partner Institute for Computational Biology, Shanghai Institutes for Biological Sciences CAS, Shanghai, China
Некоторые достижения коллектива специализации последних лет:
Впервые охарактеризован гималайский окрас домашних собак. Показано, что он определяется миссенс мутацией в гене TYR.
E. Bychkova, E. Filippova, Zh. Eliseeva, L. Barabanova, М. Sotskaya, O. Viktorovskaya, A. Markov. Identification of a candidate genetic variant for the Himalayan color pattern in dogs // Gene. 2021. 769:145212.
Охарактеризованы особенности амплификации рДНК в ооцитах красноухой черепахи Trachemys scripta с использованием ряда специфических гистохимических и цитомолекулярных методов. Полученные экспериментальные данные показывают специфический способ образования внехромосомных ядрышек и позволяют сделать ряд эволюционных обобщений на основании собственных данных и имеющихся публикаций.
Davidian A., Koshel E., Dyomin A., Galkina S., Saifitdinova A., Gaginskaya E. On some structural and evolutionary aspects of rDNA amplification in oogenesis of Trachemys scripta turtles // Cell and Tissue Research. 2021. 383:853–864.
Дрозофила - прекрасная модельная система для изучения функции гена в формировании нервной системы, нейродегенерации, в контроле расхождения хромосом, в эмбриогенезе. Использование мутаций по гену РНК-связывающего белка Dm Nxf1 позволяет исследовать взаимосвязь транспорта РНК и формирования подвижных сперматозоидов, нацеливания аксонов при формировании мозга и других морфогенетических процессов.
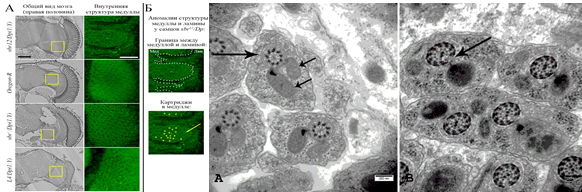
Mamon L., Ginanova V., Kliver S., Toropko M., Golubkova E. Organ-specific transcripts as a source of gene multifunctionality: lessons learned from the Drosophila melanogaster sbr (Dm nxf1) gene. // Bio. Comm. 2019. V. 64 (2), P. 146-157.
Golubkova E., Atsapkina А., K’ergaard А., Mamon L.. Spermatogenesis in Drosophila melanogaster: Key Features and the Role of the NXF1 (Nuclear Export Factor) Protein. // In: “Animal Models in Medicine and Biology.” Editors: Eva Tvrdá and Sarat Chandra Yenisetti. IntechOpen. London, UK. 2020. Chapter 9. P.151-166.
Стресс способен индуцировать de novo увеличение генетической изменчивости, дестабилизируя генетический аппарат соматических и половых клеток. Одна из моделей – феромональный стресс у грызунов.
Daev E.V. Pheromonal effects on germ cells of house mouse males: possible evolutionary consequences. Bio. Comm. 2019. 64(2):158-165.
Павлова М.Б., Вайдо А.И., Хлебаева Д.А., Даев Е.В., Дюжикова Н.А.. Стрессорная дестабилизация генома в клетках префронтальной коры, гиппокампа и костного мозга крыс с контрастной возбудимостью нервной системы. // Экологическая генетика. 2020.18(4).
|
